小鼠胚胎干细胞中Cx43诱导过表达系统的产生与表征

小鼠胚胎干细胞中Cx43诱导过表达系统的产生与表征
连接蛋白(Cx)是一个大的膜蛋白家族,可以形成细胞间的连接,即相邻细胞之间所谓的间隙连接。Cx43在哺乳动物中广泛表达,具有多种不同的功能,如在心室中电传导的传播。尽管有Cx43基因敲除模型,但许多关于Cx43在健康和疾病中的生物学问题仍未得到解答。该研究报道了在小鼠胚胎干细胞(Embryonic stem,ES)中建立一个Cre诱导的Cx43过表达系统。这使得在体细胞中研究Cx43过表达的影响成为可能。研究人员利用双报告系统,通过mCherry荧光标记过表达Cx43的细胞并通过与P2A肽融合标记外源性Cx43,以可视化其分布模式。研究人员在胚胎干细胞、HeLa细胞和3T3-成纤维细胞中证明了他们的系统的功能,并基于染料扩散和FRAP实验证明了功能性间隙连接的形成。此外,过表达Cx43的胚胎干细胞可分化为活的心肌细胞,可见横纹和自发搏动的形成。分析显示,过表达Cx43的细胞簇的跳动速度更快、更有节奏。因此,该团队的Cx43过表达系统使研究Cx43在心肌细胞和其他体细胞中的生物学和功能成为可能。
值得注意的是,研究团队使用EchoLUTION细胞培养试剂盒提取三个不同的小鼠胚胎干细胞(ES)克隆(Cre-)的基因组DNA,并通过qPCR测定拷贝数。
连接蛋白(Cx)是一个大的跨膜蛋白家族,主要定位于质膜,但也定位于胞内的细胞器,如线粒体。在小鼠中,已经鉴定出20种不同的Cx亚型。它们广泛表达于从早期胚胎发育的开始的所有器官和组织中。所有的Cx都具有相同的结构特征,包括位于细胞质中的1个氨基端和羧基端、1个胞内环和4个跨膜结构域。6个Cx形成一个连接子,相邻细胞质膜上的2个相邻连接子可以形成有功能的细胞间通道,即间隙连接。Cx生物学是复杂的,因为不同的Cx同型可以组装和形成异质连接子,甚至异型间隙连接。最近的研究提出了半通道的存在,它被认为是在病理生理条件下开放的。
已知间隙连接具有多效性功能,如交换营养物质、信号成分和分子低于1.5 kDa的离子。因此,这些蛋白质介导细胞间的电和代谢偶联。这就解释了它们的重要作用和在敲除特定的Cx基因后的早期胚胎致死性,例如Cx45。此外,Cx编码基因的生殖系甚至体细胞突变均可导致多种疾病。事实上,10种不同的人类Cx的突变与28种不同的遗传疾病有关,例如Cx26相关的耳聋、Cx46相关的白内障和Cx32相关的X连锁腓骨肌萎缩神经病变。
Cx43是Cx家族中分布最广泛和研究最广泛的成员之一,已知它在心脏中强烈表达。心脏形成电合胞体,电传导严重依赖于Cx43在心房和心室心肌细胞中的表达和功能,而Cx40优先在心房心肌细胞中表达,Cx45优先在窦房和房室结细胞中表达。在健康的人类心脏中,Cx43间隙连接主要位于连接两个相邻心肌细胞的插入盘上,提供了在整个工作心肌中的电传导的有序传播。心脏功能间隙连接对心脏功能的关键作用以Cx突变为例,Cx突变在心脏中强烈表达,导致疾病,如Cx40相关房颤和Cx43相关眼窝指发育不良。Cx43通道和/或间隙连接的表达、分布和调节的改变被认为发生在病理生理学情况下,并可能参与了危及生命的室性心律失常的发生。此外,据报道,心肌缺血和梗死可导致Cx43分布模式的改变,例如,心肌细胞侧膜上的非典型细胞定位,称为侧化;病理生理意义仍有争议。此外,据报道,缺氧和高胞质Ca2+会改变心脏Cx43间隙连接门控,从而改变电传导特性。
由于缺乏Cx的高度特异性的药理激动剂和阻滞剂,小的Cx43模拟肽的阻断作用(如Gap26,Gap27)或激动剂功能(Gap134,αCT1)已被开发出来,并用于靶向心脏病测试。除了特异性和有效性问题外,这些化合物的体内传递还需要进一步发展。大多数对Cx43在心脏发育和疾病中的功能的实际机制的理解已经从敲除(KO)小鼠模型中获得。这些研究表明,Cx43基因的零突变会导致心脏流出道的形态发生畸形和因窒息、而导致的围产期死亡。该表型主要由神经嵴细胞相关的Cx43相关缺陷引起。心肌细胞中Cx43的细胞类型特异性和可诱导性缺失导致严重的室性心律失常,强调了其在心脏电传导传播中的关键作用。这些研究还表明,只需要5-10%的Cx43蛋白才能维持其正常功能。然而,人们对Cx43在心肌细胞和心脏中的生物学和功能的许多方面仍然知之甚少,特别是Cx43对心肌细胞发育的贡献,其在疾病和故障中的影响,其侧化的相关性,以及半通道的形成和功能意义。为了解决这些问题,研究人员采用了一种不同于KOs的方法,即在多能小鼠胚胎干细胞(ES)中生成一个可诱导的Cx43过表达模型。之所以选择这种策略,是因为早期的小鼠实验表明,Cx43的普遍过表达会导致胚胎和出生后的发病率,并降低了出生后的生存能力。研究人员推断Cx43过表达可能对体外天然细胞和/或胚胎干细胞来源的细胞群的繁殖、发育和分化产生(不利的)影响。因此,研究人员认为在(ES)细胞体外分化的后期阶段,能够诱导Cx43过表达是一个明显的优势。
研究结果如下,首先,研究人员在小鼠G4 ES细胞系中诱导Cx43过表达并对其进行验证。研究人员选择使用荧光报告基因(mCherry)在多能小鼠胚胎干细胞(ES)中生成一个可诱导的Cx43过表达系统,mCherry能标记过表达细胞和一个小的可检测肽(P2A),该肽融合到外源性Cx43的C端(图1b)。为此,研究人员对由CAG启动子驱动的Cx43的诱导过表达的小鼠G4 ES细胞进行预先准备。之所以选择CAG启动子,是因为它在小鼠胚胎发育和出生后的所有阶段的肌细胞中都有很强的表达。表达盒的诱导性由一个loxP侧翼的终止信号盒提供,该终止信号盒具有三个SV40多聚腺苷酸化信号,可以被Cre蛋白活性去除(图1a)。如图1a所示,在Ai6载体(CAG-floxSTOP-Cx43-P2A)的下游克隆了由小鼠Cx43 cDNA、A-P2ADNA序列和框架内的mCherry cDNA组成的DNA片段。(图1a,b)。该载体包含Rosa26(Rs26)基因组序列,驱动表达盒同源重组到G4 ES细胞内源性Rs26位点,实现靶向的单一整合。
图1. 可诱导过表达连接蛋白(Cx)43的转基因小鼠G4 ES细胞的生成和特性分析
为获得与基因组Rs26位点的单一整合,将该结构体和特异性锌指核酸酶共转染G4 ES细胞(图1c)。研究人员随即对转染的细胞进行了表征,并通过各种方法评估了转基因成功地单次整合到单个细胞的Rs26位点:首先,用新霉素筛选10天后,分离出10个(共52个克隆)独立的转基因G4 ES细胞克隆,并进一步培养(图1c)。在10个被分析的胚胎干细胞克隆中有9个可以检测到mCherry DNA。利用与内源性Rs26序列5’或3’端和结构内序列结合的引物对对Rs26位点整合位点进行PCR分析,结果证明克隆13、17、27、29、31和52的Rs26位点被成功整合(图1d)。这6个不同细胞克隆的核型分析显示,克隆13、29和31的结果最好,大部分计数细胞(克隆13的80%,克隆29的75%和克隆31的79%)包含40条染色体(图1e)。
为了研究Rs26等位基因的一个或两个等位基因是否受到插入物整合的影响,使用Rs26特异性引物对。PCR分析得到一个297 bp的条带,表明有一个未受影响的Rs26等位基因(图1f)。进行Southern blot分析,结果证明整个表达盒(图1g,左图)整合到Rs26位点的一个等位基因中(图1g,右图),并确认每个被检测克隆的一个WT等位基因和一个转基因整合。然后,使用qPCR来确认该转基因在单个克隆中的单个整合(图1h)。这些实验表明,G4 ES细胞克隆29和31携带转基因的一个拷贝。结果还显示,克隆13最有可能携带第二个拷贝(图1h),该拷贝表现为整合在Rs26位点外,因为剩余的一个WT Rs26等位基因可以通过Southern印迹分析(使用pRs26-50探针)(图1g)以及定性PCR(图1f)被检测。因此,克隆29和31被用于进一步的实验。
接下来,通过用AAV2.1-Cre转导克隆29和31的未分化鼠G4 ES细胞来评估Cre-loxP系统的功能(图2a)。将两个转基因克隆的细胞悬液与AAV2.1-Cre混合并接种在辐照的成纤维细胞上。3天后,可见mCherry表达的菌落,表明浮动终止信号盒被Cre重组酶活性切除。由于不是所有的细胞都被成功转导,我们获得了一个含有mCherry阳性(Cre+)和mCherry阴性(Cre−)菌落的混合细胞群(图2b,中间图)。为了获得同质的Cre+转基因细胞系,我们分离了单个Cre+亚克隆,并在培养中进行了扩增(图2b,中间和右图)。所有这些细胞都被发现是mCherry+,而对照组细胞(Cre−)是 mCherry−,而不是AAV2.1-Cre转导的(图2b)。RT-PCR进一步证实了Cree-loxP系统的功能。利用匹配鸡肌动蛋白(CAG启动子)的外显子1和Cx43 cDNA的引物对,发现终止信号盒被去除,嵌合内含子被剪接出来(条带417 bp)。因此,转基因G4 ES克隆C29和C31都发挥了功能;研究人员使用了克隆31的(Cre−)和(Cre+)细胞进行后续实验。

图2. 在稳定转染的、未分化的小鼠G4 ES细胞中诱导Cx43过表达
使用免疫染色(图2c)和Western blot分析,探索了ES细胞中Cx43、mCherry和P2A的表达模式(图2d)。这些实验证明,P2A标记的Cx43和mCherry可以在Cre+中检测到,而在Cre−对照的ES细胞系中检测不到(图2c,d)。根据P2A的染色,我们发现外源性Cx43蛋白的细胞分布模式与内源性的分布模式几乎相同:两种成分都观察到细胞质和膜的位置(图2c)。重要的是,在免疫印迹分析中,Cx43表达的定量证明,在GAPDH归一化后,Cre诱导后过表达约2.5倍(图2d;n = 6)。相比之下,Cre−对照细胞的免疫染色和免疫印迹分析显示,P2A和mCherry表达缺失,强调了在没有重大免疫泄露下loxP终止信号盒的适当功能(图2c,d)。综上所述,携带CAG-floxSTOP-Cx43-P2A-mCherry结构的一个单一拷贝的可诱导的Cx43过表达G4 ES细胞系被创制,这个拷贝被整合到Rosa26位点上。
尽管证明了Cx43蛋白在多能性细胞中可诱导过表达,但这并不能证明功能性间隙连接的形成。这是一个关键的问题,因为标记的间隙连接通道被报道显示出细胞生物学特性的改变。因此,利用上述结构建立了一个转基因HeLa细胞系,以评估间隙连接的功能。选择HeLa细胞是因为它们不表达内源性的间隙连接通道。用CAG-floxSTOP-Cx43-P2A-mCherry-Ai6结构转染WT HeLa细胞,随后用新霉素筛选12天。选择单个HeLa细胞克隆,通过繁殖细胞建立转基因HeLa细胞系(Cre−)。然后,将转基因HeLa细胞系(Cre−)的细胞转导到AAV2.1-Cre病毒中,3天后可以观察到mCherry+ HeLa菌落。为了建立表达Cre+ HeLa的Cx43细胞系,我们进行了单细胞稀释(图3a)。通过对Cx43、P2A和mCherry的免疫染色和Westertblot分析进一步表征该细胞系(图3b,c)。结果显示,Cre+ HeLa细胞共表达了P2A标记的Cx43蛋白,该蛋白定位于细胞质和细胞膜上。Cre−转基因对照细胞既没有显示mCherry荧光,也没有显示Cx43或P2A的表达(图3b)。Western blot分析进一步强化这些发现(图3c)。
鉴于在HeLa细胞中可产生Cx43的诱导表达,随后使用荧光染料扩散技术探索功能性Cx43间隙连接的形成。使用两种不同的染料以区分间隙连接和胞质桥:分子量为349 Da的Alexa 350和分子量为10 kDa的Alexa 647右旋糖酐,它们的浓度均为0.5 µg/µL。通过显微镜下操作,用膜片钳移液器用各自的染料透析单个细胞,发现Alexa 350在0.5 min内扩散到几个密切接触的Cre+ HeLa细胞。在大约5 min内,发现整个细胞集落(10-20个细胞)都装载了荧光染料(图3d,上图,时间依赖性染料转移,n = 4)。 相比之下,在Cre− HeLa细胞中,没有观察到小的MW染料扩散到邻近细胞(n=5)(图3d,下图)。这些实验证明了功能性Cx43间隙连接通道的可诱导形成。
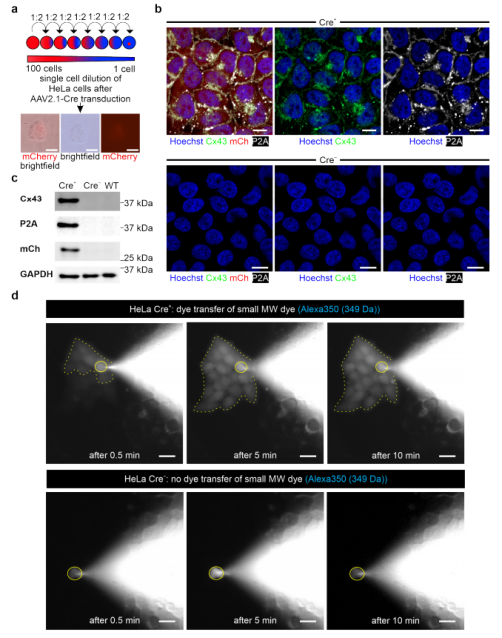
图3. 在稳定转染的HeLa细胞中诱导Cx43表达和功能性间隙连接形成
除了HeLa细胞外,我们还检测了3T3小鼠成纤维细胞的转染和转导,这些细胞已知内源性低密度表达Cx43间隙连接通道。这些实验是为了研究在内源性Cx43间隙连接存在下可诱导的Cx43间隙连接通道的形成。用CAG-floxSTOP-Cx43-P2A-mCherry-Ai6载体稳定转染3T3细胞并在新霉素下筛选12天。Cre+和Cre− 3t3成纤维细胞的免疫染色证明,如预期的那样,在mCherry+细胞中有大量的Cx43和P2A(图4a,上图),但在对照组中没有P2A且只有少量的内源性Cx43(图4a,下图)。通过Western blot分析证实,与对照组细胞相比,Cre+ 3T3-成纤维细胞中mCherry和Cx43过表达(n=4)(图4b)。利用光脱色荧光恢复(FRAP)功能性Cx43间隙连接的形成,与染料扩散相比,可以定量钙黄绿素AM染料的扩散速度。首先将细胞装载钙黄绿素AM,然后使用561 nm激光以2.5 mW的强度将细胞簇中的单个成纤维细胞漂白5s。此后,在10 min的时间内,每15 s测定一次漂白成纤维细胞中荧光强度的恢复情况(图4c,d)。实验结果表明,Cre+ 3T3-成纤维细胞在光漂白后的荧光恢复速度明显快于Cre− 细(4分钟后的Tukey多重比较试验:p(Cre− vs Cre+) < 0.0001;10分钟后:p(Cre− vs Cre+) = 0.0007;n = 6)和3T3 WT细胞(4分钟后的Tukey多重比较试验:p (WT vs Cre+) < 0.0001;10分钟后: p (WT vs Cre+) = 0.001;n = 6)。相比之下,WT和Cre− 细胞表现出非常相似的FRAP特征(4分钟后的Tukey的多重比较试验:p (WT vs Cre−)=0.9523,ns;10分钟后: p (WT vs Cre−) = 0.9651, ns; n = 6)(图4c,d)。这些实验证明,在内源性Cx43间隙连接存在的情况下,通过过表达外源性Cx43,可以增加功能缝间隙连接通道。
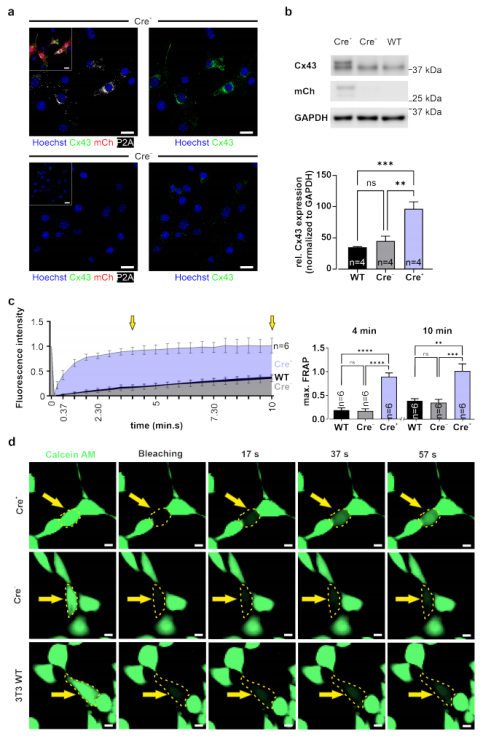
图4. 在稳定转染的3T3细胞中诱导过表达功能性Cx43间隙连接
同时使用FRAP检测了未分化的Cre+ G4 ES细胞中功能性外源Cx43间隙连接的形成,并将结果与对照的Cre− ES细胞进行比较。结果显示,在漂白4 min后,Cre+ G4 ES细胞的染料恢复速度明显快于对照组(4分钟后的双尾非配对t检验: p (Cre+ vs Cre− )=0.0005;n = 5),而在随后的时间点,对照组也显示出明显的荧光恢复(10分钟后的双尾非配对t检验: p (Cre+ vs Cre−) = 0.4905; n = 5)(图5)因为显著的内源性Cx43表达(图2c,下图)。
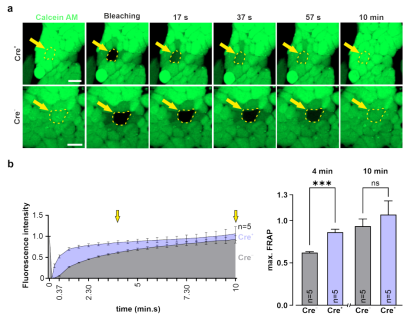
图5. Cre+ G4 ES细胞中功能性外源Cx43间隙连接的形成
使用多能性细胞作为Cx43过表达系统的一个关键优势是,它们可以在体外进行分化,并且过表达的结果可以在不同的体细胞类型中测试其发育、分化和功能。拟胚体(EBs)由Cre+或Cre− CAG-floxSTOP-Cx43- P2A-mCherry G4小鼠胚胎干细胞生成(图6a,b)。Western blot分析和免疫荧光染色证实P2A、mCherry和Cx43仅在Cre+中过表达(图6c,d,中间图)。此外,针对肌肉特异性标记物心脏α-肌动蛋白的免疫染色表现与心肌细胞分化程度相似,表明Cx43过表达并没有显著改变心肌细胞的发育和分化(图6d,左图)。通过对凋亡标记物cleaved caspase 3进行免疫染色,进一步研究Cx43过表达后心肌细胞的活力。与预期结果一致,在Cre+和Cre− EBs的中心区域优先检测到凋亡区域,但转基因和对照EBs的凋亡率没有明显差异(图6d,右图;n = 5)。随后使用基于显微镜的视频记录测量EB-衍生细胞簇的自发搏动率测定Cx43过表达是否导致功能差异。结果显示,Cre+细胞群显示出明显更高的跳动率(跳动频率= 75.9 bpm;n = 16),高于Cre−对照组(跳动频率= 60.3 bpm;n = 19;未配对t检验: p < 0.0001)(图7a)。此外,Cre+细胞簇比Cre−对照更有规律,因为它们在5 min周期内以1 Hz产生的标准差(SD)分别为1.9和5.3(未配对t检验: p < 0.0001;n(Cre+)=16,n(Cre−)=19)(图7a)。这些实验证明,尽管Cx43过表达,但Cre+心肌细胞的体外分化特征仍完整。

图6. 在稳定转染的小鼠G4 ES细胞(克隆31)中诱导Cx43(过)表达,体外分化为心肌细胞
病毒是靶向细胞和组织的有力工具,为通过另一种方式检测Cx43在体外和体内的过表达,生成一种AAV2.6-Cx43-P2A-mCherry病毒。选择AAV2.6型是因为这种血清型不仅可以转导肌肉细胞,还可以转导其他类型的细胞,如中枢神经系统。研究人员测试了该病毒在常作为体外模型的新生小鼠心肌细胞(NNCMs)中的可行性和实用性,因为成年心肌细胞在培养中迅速去分化而不能用于这类实验。富集的NNCMs(图7b)在转导后分别用病毒处理2天和3天;观察到mCherry+NNCMs(图7c,上图)。AAV2.6-Cx43-P2A-mCherry病毒在NNCMs中的转导效率为47.7%(n=3,共1113个NNCMs中的531个mCherry+NNCMs)(图7c,表)。免疫荧光染色证实了在mCherry+NNCMs中P2A标记的Cx43过表达(图7d,上图)。在对照组(图7d、第二和第四图)和转导的心肌细胞(图7d、上图和第三图)中,Cx43的细胞分布主要局限于细胞膜上;在很小的程度上,也检测到了胞质定位。mCherry+细胞心脏α-肌动蛋白染色阳性证实了NNCMs的成功靶向(图7d,第三图)。这些实验证明了一种基于病毒的转导系统的成功开发,该系统允许靶向过表达Cx43,以及mCherry和P2A标记。
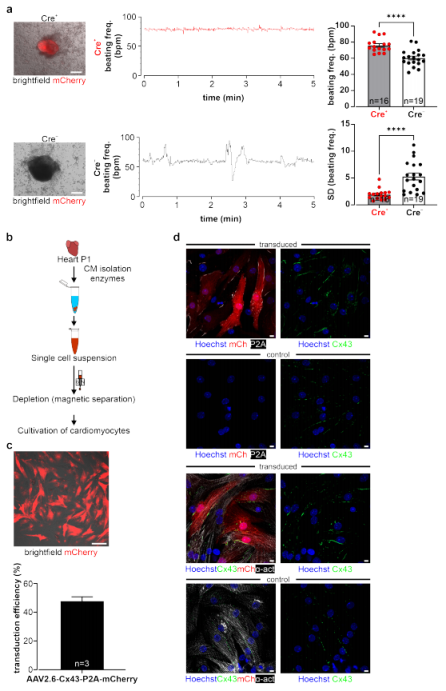
图7. Cx43过表达在小鼠G4 ES细胞来源的EBs中的功能影响;用AAV2.6-Cx43过表达病毒靶向小鼠新生儿心肌细胞(NNCMs)
综上所述,研究人员在小鼠胚胎干细胞中建立了可诱导Cx43过表达系统和AAV-Cx43过表达系统,能够研究Cx43的细胞生物学和功能结果。结果显示,将表达Cx43的肌细胞移植到梗死区域或在瘢痕的肌成纤维细胞中过表达Cx43可显著降低小鼠梗死后室性心动过速的发生率。尽管这些策略在特定的患者队列中具有巨大的转化潜力,但Cx43在心肌细胞和非心肌细胞中(过度)表达的潜在细胞生物学(如细胞分化、成熟、活力)和功能(如离子通道和转运体的表达)的缺陷有待研究。体外胚胎干细胞分化系统非常适合用于这一目的。同样,也有人认为,某些形式的癫痫可能受益于星形胶质细胞中Cx43间隙连接通道的开放程度的增加。因此,新的Cx43间隙连接激活剂和开启剂可以在来源于胚胎干细胞的星形胶质细胞中研究它们对Cx43间隙连接通道的影响。此外,这种Cx43调节剂的潜在不良影响可以在转基因胚胎干细胞来源的心肌细胞的安全性药理学方面进行研究。含有CAG-floxSTOP-Cx43-P2A-mCherry结构的转基因G4 ES细胞可用于生成转基因小鼠。这种小鼠模型将允许测试Cx43在任何细胞类型中过表达的治疗潜力,这取决于与Crea-deleter小鼠系的交叉。例如,对于研究心律失常的小组来说,诱导边界区心肌细胞或疤痕区肌成纤维细胞同质过表达,研究心肌梗死后室性心律失常的影响是非常有意义的。


